Réactions acido – basiques en solution
aqueuse
Synthèse C5
I Produit
ionique de l’eau
La réaction d’autoprotolyse
de l’eau à lieu dans toute solution aqueuse. L’équation s’écrit :
2H2O (l) = H3O+
(aq) + OH- (aq)
On appelle produit ionique de
l’eau la constante d’équilibre Ke
de la réaction d’autoprotolyse de l’eau.
La valeur de KE dépend de la température. 25 °C, Ke = 1,0.10-14 .
Dans toute solution aqueuse,
on a la relation :
[H3O+]eq
.[OH-]eq = Ke
II Echelle de
pH
On définit le caractère acide,
basique ou neutre d’une solution par
comparaison de son pH avec celui de l’eau pure.

III Constante
d’acidité d’un couple acide/base
La constante d’équilibre de
la réaction d’un acide AH avec l’eau est la constante d’acidité KA du couple acide/base
correspondant AH (aq)/A- (aq). Elle dépend de la température
AH(aq) + H2O
(l) = A- (aq) + H3O+ (aq) KA = 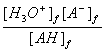 ( concentration molaire à l’état final)
( concentration molaire à l’état final)
Le pKA d’un couple
acide / base est défini par la relation
pKA = - log KA
La constante d’équilibre
d’une réaction acido-basique peut être déterminée à partir des constantes
d’acidité des couples acide / base en
présence :
A1H (aq) + A2-(aq)
= A1-(aq) + A2H (aq) K = KA1/KA2
IV Force d’un acide ou d’une base
Un acide est d’autant plus
fort que le pKA du couple auquel il appartient est petit.
Une base est d’autant plus
forte que le pKA du couple auquel elle appartient est élevé.

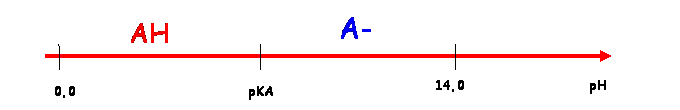
V Espèces prédominantes
Une espèce A prédomine par
rapport à une espèce B si [A] > [B]
Le diagramme de prédominance représente
les zones de pH où les espèces d’un couple prédominent.
La zone de virage d’un
indicateur coloré se situe dans une zone de pH encadrant son pKA
VI Les
titrages acido-basiques
VI -1Définition :
Titrer l’espèce A en solution
consiste à la faire réagir avec une espèce titrante B . On effectue des ajouts successifs
de la solution titrante, de concentration connue, dans une prise d’essai de la
solution à titrer. On repère l’équivalence. Dans un titrage acido-basique, la
réaction de titrage est une réaction acido-basique.
La transformation associée à
la réaction de titrage doit être rapide, totale et spécifique de l’espèce à
titrer.
VI-2 Titrage
pH-métriques
Lors d’un titrage
pH-métriques, l’observable est le pH de la solution.
Sur la courbe de titrage pH =
f(V), on observe un saut de pH aux alentours du point d’équivalence.
Le point d’équivalence peut
être repéré :
·
graphiquement
à l’aide de la méthode des tangentes ;
·
par
lecture ou par le calcul de l’extremum de la fonction dérivée d(pH) /dV

VI-3 titrages
colorimétriques
Lors d’un titrage
colorimétrique, l’observable est la couleur de la solution. Le changement de
couleur est provoqué par le virage d’un indicateur coloré.
Un indicateur coloré est bien
choisi si sa zone de virage contient le pH à l’équivalence. L’ajout d’une seule
goutte de réactif titrant doit correspondre au virage de l’indicateur coloré


Pour accéder à l’applet
sur le dosage
JM Podvin Juillet 2002