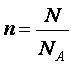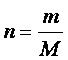La mole, unité de
quantité de matière en chimie
Une mole est un gros paquet d’entités, c’est une
quantité constante, qui utilisée essentiellement
pour
des entités microscopiques ( atomes, ions etc ….)
A une mole correspond :
-
un nombre d’entités chimiques (NA)
- une quantité de matière (1 mol)
- une masse : la masse molaire (M)
- un volume : le volume molaire (Vm
principalement utilisé pour les gaz)
|
Nombre d’entités chimiques Une mole contient un nombre
fixe d’entités, qui est le nombre d’atomes de carbone 12 dans 12 g de carbone
12 Ce nombre est égal à la
constante d’Avogadro et vaut : NA = 6,02.1023
entités Relation liant nombre
d’entités (N) et quantité de matière (n)
en mol |
Quantité de matière (en mol) La quantité de matière (n)
contenue dans un échantillon de masse (m) et de masse molaire (M) se déduit de la relation
suivante : Pour les gaz (et parfois
les liquides), on peut utiliser une autre relation liant le
volume de l’échantillon (V) et le volume molaire du gaz (Vm) Dans ce cas
|
|
Masse molaire ( en g.mol-1) Elle correspond à la
masse d’une mole d’entités. Pour un atome, la masse
molaire atomique se trouve dans la classification périodique Pour un ion monoatomique, la masse molaire est
pratiquement égale à celle de l’élément chimique correspondant. Exemple : Mcu2+
= MCu = 63,5 g.mol-1 Pour une molécule, la masse
molaire moléculaire est égale à la somme
des masses molaires atomiques des éléments chimiques qui la composent. |
Volume molaire ( en L.mol-1) Loi d’Avogadro Ampère. Dans les mêmes
conditions de température et de pression, tous les gaz ont le même volume
molaire (Voir 3eme
trimestre ® loi des gaz parfaits) Voici deux exemples : T = 0° C et P = 1013 hPa Vm = 22,4 L.mol-1 T = 20°C et P = 1013 hPa Vm = 24 L.mol-1 On remarque que le volume
molaire augmente avec la température. |