Etat d’équilibre
d’un système
Synthèse C4
I
Conductimétrie
La conductivité σ d’une solution électrolytique est liée à la
conductance G d’une portion de cette solution par la relation :
σ = k.G
σ est exprimée en S.m-1 ; G en S ;
k est la constante de cellule conductimétrique en m-1
La conductivité est
indépendante du système de mesure et ne dépend que des caractéristiques de la
solution (nature, concentrations des ions et température)
La conductivité d’une
solution électrolytique peu concentrée, constituée de p ions monochargés Xi ( i
variant de 1 à p), de concentrations [Xi] et de conductivités molaires ioniques
λi, est donnée par la relation
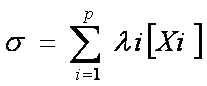
σ est exprimées en S.m-1, λi en S.m².mol-1 ; [Xi] en mol.m-3

II Quotient
de réaction
·
On
considère un système chimique en solution aqueuse, susceptible de subir une
transformation modélisée la réaction d’équation
aA
(aq) + bB (aq) = cC (aq) + dD (aq)
Dans
un état donné du système, le quotient de réaction est un nombre sans dimension,
qui s’écrit :
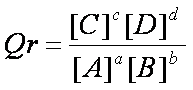
·
S’il
est réactif, le solvant eau est représenté par le chiffre 1 dans l’expression
du quotient de réaction.
·
Dans
le cas d’un système hétérogène mettant en jeu une solution aqueuse et des
solides, les solides sont représentés également par le chiffre 1 dans le
quotient de réaction.
III Constante
d’équilibre
A chaque équation de
réaction, on associe une constante d’équilibre K, qui ne dépend que de la
température.
A l’équilibre et uniquement à
l’équilibre, on a la relation
Qr, eq = K (état final du système)
La constante d’équilibre
associée à une transformation totale a une valeur élevée ( K > 1.10-4
)
Les constantes d’équilibre associées
à deux réactions inverses sont inverses l’une de l’autre :
IV Taux
d’avancement final d’une réaction.
Pour une transformation
donnée, le taux d’avancement final dépend de la constante d’équilibre et de
l’état initial du système chimique.
(voir exercices)
JM Podvin Juillet 2001