Synthèse chimie 9
Réactions d’estérification et d’hydrolyse
I
Estérification et hydrolyse
Les esters sont une famille
de composés organiques de formule générale

Une réaction d’estérification
modélise la transformation chimique spontanée qui conduit à la formation d’un
ester et d’eau d’un acide carboxylique et d’un alcool.
La réaction d’hydrolyse est
la réaction inverse de l’estérification. Une transformation modélisée par une
réaction d’hydrolyse est également spontanée.
II
L’équilibre estérification – hydrolyse
Les transformations
modélisées par une réaction d’estérification ou d’hydrolyse sont limitées.
Elles conduisent à un état d’équilibre et sont formalisées par les équations
suivantes
R - COOH + R’OH = R – COOR’ + H2O
(estérification)
R – COOR’
+ H2O = R-COOH + R’OH (Hydrolyse)
III Contrôle
de l’état final
Le rendement d’une
transformation est égal au taux d’avancement final en % de la réaction associée :
rendement
= t x 100
Pour augmenter le rendement
d’une réaction d’estérification, on a
trois possibilités :
·
utiliser
l’un des réactifs en excès ;
·
ajouter
l’un des réactifs lorsque l’état d’équilibre est atteint ;
·
éliminer
l’un des produits au fur et à mesure.
Dans les deux derniers cas,
on dit que l’on déplace l’équilibre dans le sens direct.
IV Contrôle
de la vitesse de réaction.
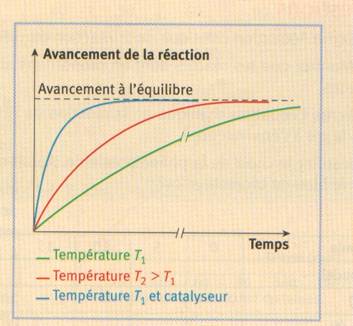
Les transformations associées
à des réactions d’estérification ou d’hydrolyse sont lentes. Pour augmenter la
vitesse de ces transformations, on peut augmenter la température ou utiliser un
catalyseur.
Un catalyseur est une espèce
qui augmente la vitesse d’une réaction chimique et de sa réaction inverse mais
qui ne figure pas dans l’équation de la réaction.
Pour une estérification ou
l’hydrolyse d’un ester, la température et la présence d’un catalyseur n’ont
aucune influence sur l’état d’équilibre du système.